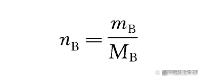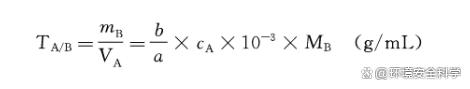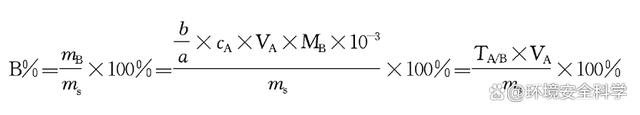有色金属分析中的标准溶液
|
标准溶液的制备是分析工作中最重要的基本操作之一。标准滴定溶液是确定了准确浓度的、用于滴定分析的溶液。标准溶液是准确知道其中某种元素、离子、化合物或基团浓度的溶液。
(1)标准滴定溶液 标准滴定溶液浓度的表示方法有以下两种。 ①物质B的物质的量浓度 物质B的物质的量浓度简称物质B的浓度。其定义为:物质B的物质的量nB除以溶液的体积V,其国际符号是cB,单位是mol/L。用物质的量浓度进行计算时,往往还要知道物质B的质量mB和摩尔质量MB。故物质B的物质的量nB可由下式求得:
式中,mB常用的单位为g;MB常用的单位为g/mol。 ②滴定度 滴定度是指与每毫升标准溶液相当的被测物质的质量(单位:g/mL)。 在生产部门的例行分析中,为了计算方便,常用滴定度表示标准溶液(滴定剂)的浓度。引入滴定度可使计算过程变得简便。a.由滴定用去的标准溶液体积,可求出被测物的质量;b.当固定称样量时,根据滴定液体积,可直接求出被测物质的百分含量。若以A滴定B的反应aA bB=cC dD为例,则A对B的滴定度的计算通式为:
物质B在试样中的质量分数为:
在实际应用中滴定度还有另外一种表示方法,如固定试样称样量,滴定度可直接表示每毫升标准溶液相当于被测物质的质量分数(或百分含量,%)。如用K2Cr2O7法测定铁时每次固定称量试样3.000g,某次滴定用去标准溶液37.92mL,则Fe%=37.92%。
标准滴定溶液和标准溶液的配制、使用、保管应严格按产品标准执行。对于一般化工产品检验用液,目前多选用GB/T 601~602来配制。 配制标准滴定溶液通常有直接法和标定法两种。直接法是准确称取一定量的基准试剂,溶解后配成准确体积的溶液。由基准试剂的质量和配成溶液的准确体积可直接求出该溶液的准确浓度。标定法是首先配制一种近似的所需浓度的溶液,然后用基准试剂或已知准确浓度的另一种标准溶液来标定它的准确浓度。 标定有色金属溶液的浓度时,准确性和重现性是很重要的。标定法配制的标准溶液仅适用于化学测定方法。标定时所用的基准试剂为滴定法分析工作基准试剂。
在配制标准溶液时,所用水在没有注明其他要求时均使用三级水;所用试剂的纯度应在分析纯以上;工作中所用分析天平的砝码、滴定管、容量瓶及移液管均需定期校正,以确保称量和体积确定的准确。在标定和使用时如温度差异较大,应按不同标准溶液浓度的温度校正值进行修正。所制备的标准溶液的浓度均指20℃时的浓度。在标定标准溶液浓度时,平行试验不得少于8次;两人各做四个平行试验,每人四个平行测定结果的极差与平均值之比不得大于0.1%;两人测定结果平均值之差不得大于0.1%,结果取平均值,运算过程保留五位有效数字,浓度值报出结果取四位有效数字。配制浓度等于或低于0.02mol/L的标准溶液(乙二胺四乙酸二钠标准滴定溶液除外)时,应于临时用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。容量分析标准溶液在常温(15~25℃)下,保存时间一般不得超过两个月。当溶液出现浑浊、沉淀、颜色变化等现象时,应重新制备。 容量分析用标准溶液的制备应按GB/T 601~2016《化学试剂标准滴定溶液的制备》中的方法,该标准规定了常用的标准滴定溶液。 (2)标准溶液 适用于原子吸收光谱法、原子发射光谱法、极谱法、伏安溶出法、比色法、分光光度法等元素分析用的标准溶液,其浓度以质量浓度表示,单位为g/L、mg/mL或以其分倍数表示。配制的浓度范围在0.05%~1.0%(50~1000μg/mL)内为宜,常可以保存几个星期乃至数月。浓度更稀的溶液(低于0.1mg/L)常在使用前临时用较浓的标准溶液在容量瓶中稀释并配制。因为太稀的离子溶液浓度易变,不宜存放太长时间。为使贮备的标准溶液稳定,不致因时间长产生化学反应引起浓度变化和沉淀,应配成稳定的、高浓度的贮备溶液。配制标准溶液时,应使用离子交换水或蒸馏水。做痕量元素分析时,必须使用去离子水或二次蒸馏水。在贮存与配制过程中,必须十分注意溶液的污染问题。贮存标准溶液的容器应根据溶液的性质来选择,其材料不应与溶液起理化作用,壁厚最薄处不小于0.5mm。容器洗净后干燥,再用贮存溶液洗几遍,然后将溶液注入。一定要在容器上标明配制日期、浓度、配制者姓名及其他注意事项。在保存期内,出现浑浊或沉淀时,即为失效。
标准溶液使用中常用吸量管移取,当移取量小于0.05mL时,应将浓溶液稀释至适当浓度后再移取。标准溶液是已知元素离子准确含量的溶液,其制备方法有直接法和标定法两种。直接法可采用基准有色金属纯盐直接溶解配制或采用超纯有色金属单质溶解后配制。采用基准化合物,如光谱纯基准试剂(NH4)2IrCl6、(NH4)3RhCl6等可直接溶解配制,其浓度由直接称取的基准化合物的质量计算得到。 有色金属标准溶液是有色金属分析的参考物,其浓度是否准确将直接影响试样的测定误差。标定法配制标准溶液主要考虑的是购买的有色金属化合物或金属纯度不符合基准物质的要求,但将其制备成溶液后,可利用该物质与基准物质之间的化学反应来标定其浓度。 常用的金属元素和离子的标准溶液配制方法参照GB/T 602—2002。 (3)特殊用途标准溶液 例如校正仪器专用标准溶液。如分光光度计的校正,酸度计(标准缓冲溶液,温度一定,溶液的pH值一定)的校正和定位。用优级纯或分析纯试剂,并用实验室三级水配制。按GB/T 602—2002来配制。 (4)影响有色金属标准溶液稳定性的因素 有色金属标准溶液的贮存是一个很重要的问题,也就是涉及其稳定性问题。主要有以下影响因素: ①关于有色金属溶液的稳定性 有色金属的化合物在不同pH条件的水溶液中可能发生水解或水合反应、聚合反应和氧化还原反应,使其形态发生变化。某些溶液见光分解,如银盐对光非常敏感,多数银盐在强光照射下发生分解而被吸附,银标准溶液因受光的影响故需保存在棕色容器中。由于易挥发组分的挥发,对于锇、钌标准溶液的贮存,还应考虑挥发损失的问题,在c(HCl)=1mol/L介质中,钌溶液保存在石英或玻璃容器里可稳定4个月,锇溶液只能稳定两个月。 ②容器对金属离子的吸附,其本质并不十分清楚 一般认为有离子吸附,也可能有分子吸附。这与容器的种类、溶液的酸度和贮存时间有关。溶液酸度愈高,吸附愈少;酸度愈低,吸附愈多。究其原因,可能是在酸性溶液中大量的H 代替了容器对有色金属离子的吸附。彻底清洗容器可以大大降低吸附,清除玻璃表面的油污后,其吸附能力明显降低。适当的预处理可以改变容器的特性,如采用酸预处理玻璃容器,可大大降低玻璃容器的吸附作用。贮存时间越长,离子的吸附损失越大,故缩短贮存时间有助于降低吸附。 ③有色金属标准溶液的稳定性与其浓度有关 高浓度有色金属溶液可以保存较长时间,而浓度愈低,保存的时间愈短。因此,配制标准溶液应先配制浓度较高的贮备液,然后逐级稀释至所需要的浓度。 另外,玻璃与水和试剂作用、试剂瓶密封不好等因素也会影响标准溶液的稳定性。因此,有色金属分析用标准溶液在常温(15~25℃)下,保存时间一般不得超过两个月。 |